27) Una de las mayores peculiaridades del hidrógeno: Coeficiente de Joule-Thomson
Es sabido por todos que al comprimir un gas, por norma general, se calienta y en su defecto, al descomprimirlo o expandirlo se enfrían. En cambio, el gas de hidrógeno no sigue ese comportamiento, dado que al descomprimirse se calienta y al presurizarlo se enfría.
¿Quién y cuando se descubrió?
El efecto Joule-Thomson se observó por primera vez en un experimento realizado por James Prescott Joule y William Thomson en 1852 y es un proceso termodinámico que ocurre cuando un fluido se expande de alta presión a baja presión a una entalpía constante.
¿Cómo se puede medir de forma experimental?
Un gas con una presión, temperatura y volumen (p1, T1, V1) que fluye a través de una membrana porosa, empujado por un pistón a presión (p1), el gas se expande contra un pistón a una presión más baja p2 hasta que todo el gas ha sido transferido al otro lado de la membrana con un volumen final V2 y temperatura T2, y luego el coeficiente Joule-Thomson se puede calcular por la presión y la temperatura cambios antes y después de la expansión.
¿Qué es el coeficiente de Joule-Thomson?
El coeficiente de J-T es la relación entre la disminución de temperatura y la caída de presión y se expresa en términos del coeficiente de expansión térmica y la capacidad calorífica.
¿En que afecta?
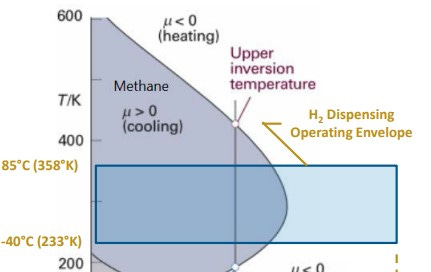
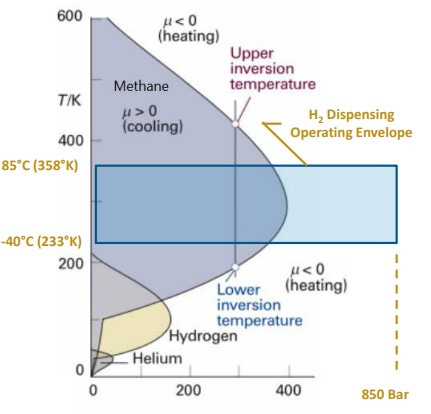
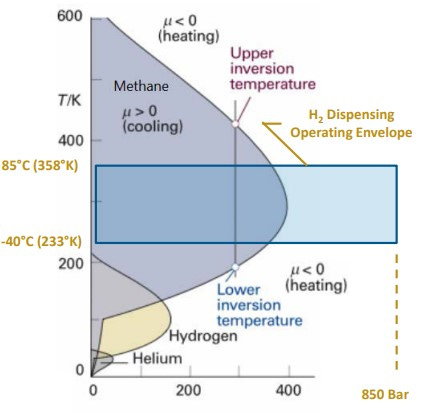
La particularidad de disponer de un coeficiente de Joule-Thomson (μ) negativo resulta de gran importancia, dado que cuando se pretenda dispensar hidrógeno gaseoso a una presión de 700bar a un tanque tipo IV de un vehículo propulsado con pilas de combustible, será necesario pre-enfriar el gas para evitar el calentamiento producido por la expansión.
En caso de fuga al ambiente de algún hidroducto o tanque de almacenamiento, no sería una característica extremadamente peligrosa, dado que si la ventilación es adecuada, y gracias a la baja densidad y alta difusividad el gas no tendría la capacidad de aumentar la temperatura del ambiente.
Para la mayoría de los gases reales en condiciones ambientales, μ es positivo, es decir, la temperatura cae a medida que se expande. Sin embargo, el hidrógeno, helio y neón tienen μ negativo y actúan de manera contraria al resto de gases.
¿Qué es la temperatura de inversión?
La temperatura de inversión en termodinámica es la temperatura crítica por debajo de la cual un gas no ideal que se expande a entalpía constante experimentará una disminución de temperatura, y por encima de la cual experimentará un aumento de temperatura.
Dicho de otra manera, la temperatura en la cual el coeficiente de Joule-Thomson varía de signo, se llama temperatura de inversión.
Aquí podéis observar como varía según la naturaleza de cada gas, la temperatura superior de inversión para alguno de los gases:
Helio (43K)
Hidrógeno (202K)
Neón (260K)
Aire (603K)
Nitrógeno (623K)
Oxigeno (761K)
Metano (939K)
27) One of the biggest peculiarities of hydrogen: Joule-Thomson coefficient
It is known by all that when compressing a gas, as a general rule, it heats up and, failing that, when decompressing or expanding it, it cools down. On the other hand, hydrogen gas does not follow this behavior, since when it is decompressed it heats up and when it is pressurized it cools down.
Who and when was it discovered?
The Joule-Thomson effect was first observed in an experiment by James Prescott Joule and William Thomson in 1852 and is a thermodynamic process that occurs when a fluid expands from high pressure to low pressure at a constant enthalpy.
How can it be measured experimentally?
A gas with a pressure, temperature and volume (p1, T1, V1) flowing through a porous membrane, pushed by a piston at pressure (p1), the gas expands against a piston at a lower pressure p2 until all the gas has been transferred to the other side of the membrane with a final volume V2 and temperature T2, and then the Joule-Thomson coefficient can be calculated from the pressure and temperature changes before and after the expansion.
What is the Joule-Thomson coefficient?
The J-T coefficient is the relationship between the temperature decrease and the pressure drop and is expressed in terms of the coefficient of thermal expansion and the heat capacity.
What does it affect?
The particularity of having a negative Joule-Thomson (μ) coefficient is of great importance, since when it is intended to dispense gaseous hydrogen at a pressure of 700bar to a type IV tank of a vehicle powered by fuel cells, it will be necessary to -cool the gas to avoid heating produced by the expansion.
In the event of a leak into the environment from a hydroduct or storage tank, it would not be an extremely dangerous characteristic, since if the ventilation is adequate, and thanks to the low density and high diffusivity, the gas would not have the capacity to increase the temperature of the environment. .
For most real gases at ambient conditions, μ is positive, that is, the temperature drops as it expands. However, hydrogen, helium and neon have negative μ and act in the opposite way to other gases.
What is inversion temperature?
The inversion temperature in thermodynamics is the critical temperature below which a non-ideal gas expanding at constant enthalpy will experience a decrease in temperature, and above which it will experience an increase in temperature.
In other words, the temperature at which the Joule-Thomson coefficient changes sign is called the inversion temperature.
Here you can see how the upper inversion temperature for any of the gases varies depending on the nature of each gas:
Helium (43K)
Hydrogen (202K)
Neon (260K)
Air (603K)
Nitrogen (623K)
Oxygen (761K)
Methane (939K)