114) Descarbonización del acero: Reducción directa de hierro (H₂-DRI).
Uno de los usos que tendrá el hidrógeno en el futuro.
Desde que comenzó la ola del hidrógeno hace aproximadamente 4 años, muchos son los usos que se le han estimado al hidrógeno. Es por todos sabido que hoy en día, que la producción y consumo de hidrógeno han estado muy ligados al refino de petróleo y a la fabricación de fertilizantes vía amoniaco. En España se consumen anualmente, 0,5Mt de H₂, distribuidas a grandes rasgos entre 70% refinerías y 30% para la fabricación de amoniaco. En la siguiente infografía que he elaborado, podéis observar los principales usos en las refinerías.
Sin embargo, a la par que se vaya desarrollando la capacidad de generación de hidrógeno renovable, el uso del hidrógeno ira destinándose a otros procesos industriales donde sea la solución sostenible técnica y económica más viable. Es aquí donde se enmarca este análisis. El uso de hidrógeno puro en el sector siderúrgico tiene muy poco recorrido en el pasado, pero hoy aprenderéis un uso que, muy posiblemente, se instauré en el futuro. La reducción directa de hierro.
Según el informe de “Net Zero Steel: Sector Transition Strategy” del 2021, para la producción de 1 MT de acero crudo basado en H2-DRI-EAF, una sola planta siderúrgica que emplease hidrógeno en lugar de combustibles fósiles para reducir hierro utilizaría alrededor de 60.000 T H2/año, lo que supondría utilizar 1 GW por medio de electrolizadores (con un factor de carga de 33%). Por lo tanto, se requieren 60kg H2 para producir 1 T de acero verde.
El uso de atmosferas reductoras en la industria no es nuevo, ya se emplea hidrógeno en la industria alimentaria para convertir grasas líquidas insaturadas (aceites comestibles con doble enlace de carbono, C=C) en grasas sólidas saturadas y parcialmente saturadas (margarinas con enlaces simples de carbono, C-C). Asimismo, en la industria de los tratamientos térmicos de acero o de materiales cerámicos es habitual el empleo de atmósferas reductoras para ciertos tratamientos de recocido .
Como podemos comprobar en la imagen 1, la reducción química de un óxido de hierro a Fe0 mediante CO derivado del reductor sólido como el carbón o por gas de síntesis (mezcla de CO/H2) produce CO2. La descarbonización de la fabricación de hierro implica sustituir el carbón o el gas natural por hidrógeno, ya que aporta una atmósfera reductora válida para replicar el proceso. Análogamente, la demanda de calor de la planta puede ser generada mediante la combustión de hidrógeno.
Quien quiera aprender sobre hidrógeno ya sabe que hacer…. De hecho, puedes activar la prueba gratuita de 7 días, y veras si el contenido lo merece. ¡No pierdes nada!
Alrededor del 5% de la corteza terrestre es hierro. El hierro al tratarse de un elemento inestable en la naturaleza, por norma general, aparece formando óxidos u otros compuestos (hidróxidos, carbonatos…).
Como se puede comprobar en la siguiente tabla, el contenido del hierro varía en función de la composición química de cada mineral. El contenido de hierro clasifica en 3 grupos los minerales de hierro. En primer lugar, de alto grado (>65% Fe), grado medio (62–65% Fe) y bajo grado (<62% Fe). Cabe resaltar que un mayor contenido en hierro en el sustrato inicial favorecerá la reducción por hidrógeno al minimizar las impurezas presentes.

Si el contiendo de hierro no es suficiente, además de calcinaciones cuando se tratan carbonatos o hidróxidos, se utilizan varios procesos de mejora, como separación por gravedad, flotación y separaciones magnéticas para la obtención de concentrados de mineral de hierro.
Dicho mineral de hierro preconcentrado, mediante un tratamiento físico de trituración y molienda, suele convertirse en pellets, en los que también se suelen incorporar los fundentes y escorificantes. La uniformidad del tamaño de los pellets, junto con su porosidad son parámetros críticos para favorecer una buena reducción del óxido de hierro.
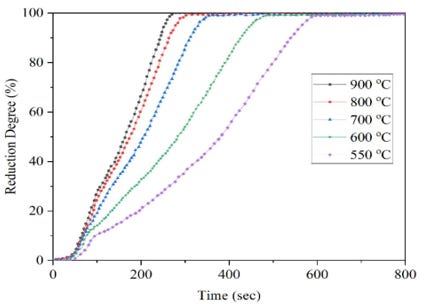
Entre los parámetros que influyen en la reducción del mineral de hierro, el más importante es la temperatura. La temperatura a la que ocurre la reacción determinará el número de etapas necesarias para lograr la reducción del mineral de hierro.
Como podemos observar seguidamente, la reducción se puede dar en 2 o 3 etapas. Por debajo de 450ºC la fase de wüstite (FeO) no aparece y por lo tanto, en dos etapas se consigue alcanzar el hierro elemental. Sin embargo, como se explicará más adelante, para favorecer la reducción será necesario operar a temperaturas superiores a 570 ºC, aunque ello implique 3 etapas de reducción.
Fe2O3 → Fe3O4 → Fe T < 450 ºC (1)
Fe2O3 → Fe3O4 → FexO + Fe → Fe 450 °C < T < 570 ºC (2)
Fe2O3 → Fe3O4 → FeO → Fe T >570 ºC (3)
Normalmente, la difusión del gas en la capa externa del mineral se excluye poniendo una alta relación de velocidad de paso lineal del gas con respecto al solido. Asimismo, la difusión interna del gas, puede ser la etapa limitante si el tamaño del pellet es grande. Pero si asumimos que el tamaño medio de la partícula es muy pequeño, la etapa limitante será la reducción química del hierro.
En esa tesitura, el efecto de la temperatura sobre la cinética de reacción es consecuencia de la dependencia de la constante de velocidad que se explica por la ecuación de Arrhenius (Ecuación 1), donde "k" es la constante de velocidad, "A" es el factor de frecuencia, que está relacionado con la frecuencia de las colisiones y la probabilidad de la orientación de una colisión favorable, “Ea” es la energía de activación, “R” es la constante del gas ideal y “T” es la temperatura en Kelvin.
Por tanto, la velocidad de reducción aumentará exponencialmente al aumentar la temperatura. En la Imagen 6, podemos observar la dependencia positiva de la temperatura en la tasa de reducción. Principalmente, las causas de este fenómeno son debidas al aumento de la difusividad y de la velocidad de reacción.
En lo que al proceso de reducción del mineral de hierro se refiere, al tratarse de un proceso de reducción gas-sólido, la cinética de la reacción, como ya se ha indicado, dependerá de la difusión del agente reductor.
Por lo tanto, emplear hidrógeno gas, en vez de monóxido de carbono, proporcionará una ventaja competitiva, dado que el hidrógeno es la molécula más pequeña del universo y su difusión a través de los poros es más rápida y sencilla.
Tal es el caso que, en ciertos estudios realizados, al hidrógeno se le atribuye una difusividad 10 veces superior a la de CO. Cabe destacar que las impurezas presentes en el mineral de hierro tienen un impacto sobre la cinética de reducción y la termodinámica. No obstante, la necesidad de una mayor pureza del mineral de hierro tiene un coste directo en su precio de adquisición.
En lo que a la operativa del proceso se refiere, los pellets del mineral de hierro se alimentan por la parte superior mediante una tolva al horno de cuba en un proceso continuo, donde a contracorriente se alimenta el hidrógeno gas al reactor solido-gas a una temperatura de 900ºC. Aunque el proceso puede operar a presión atmosférica, aumentar la presión (6-8 Bar) podría tener un impacto positivo en la difusividad del gas reductor y posibilitar a una cinética más rápida.
Cuando se emplea monóxido de carbono como agente reductor, la reacción es ligeramente exotérmica ((∆H = -23,4 KJ/mol). Sin embargo, que cuando se emplea hidrógeno, la reacción es endotérmica (∆H = 99,5KJ/mol) . Por lo tanto, las altas temperaturas favorecen la reacción.
Seguidamente se pueden observar las reacciones químicas de reducción del mineral de hierro para la obtención de hierro puro mediante hidrógeno, y las reacciones donde el reductor es el monóxido de carbono (CO) son idénticas, pero el producto obtenido es dióxido de carbono (CO2), en vez de agua.
3 Fe2O3 (s) + H2 (g) —> 2 Fe3O4 (s) + H2O (g) (rec. 1)
Fe3O4 (s) + H2 (g) —> 3 FeO (s) + H2O (g) (rec. 2)
FeO (s) + H2 (g) —> Fe (s) + H2O (g) (rec. 3)
En la primera reducción, el contenido en peso de oxígeno de Fe2O3 varía de 30,67% a 27,64% en su forma molecular de Fe3O4, es decir, una pérdida de 3,03%. En segunda instancia, se reduce hasta FeO que contiene un 22,27%, siendo necesario reducción del 5,37%. Finalmente, es esa última etapa la que necesita reducir un 22,27% hasta que el hierro alcance su forma elemental Fe0 (0% Oxígeno). Por lo tanto, en esa última etapa convergen una cinética más lenta y una mayor cantidad de oxígeno a reducir.
Como se observar en la Tabla 4, con los valores de la capacidad reductora másica específica, el potencial reductor del H2 es 14 veces mayor al del monóxido.
Ya que, un gramo de H2 es capaz de reducir 14 veces más reactivo que su homólogo CO. (Reducción Fe2O3 —> Fe3O4 = 239,5/17,1 = 14).

Como se puede observar en la Figura 5, las dos primeras etapas de reducción del mineral de hierro siguen el modelo de tamaño de partícula constante con núcleo decreciente. Sin embargo, en la reducción de FeO a Fe, como se puede contemplar en la ilustración, el núcleo del hierro se densifica, reduciendo su tamaño.
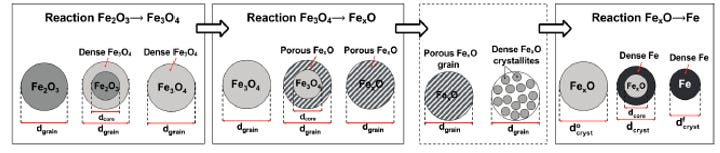
Asimismo, como se puede observar en la siguiente ilustración, el gradiente de reducción siempre es radial, partiendo de la capa externa y finalizando la metalización en el núcleo de la partícula. El termino metalización establece el % de eficacia de la reducción del óxido de hierro a su forma elemental.

El gas reductor se inyecta desde la parte inferior del reactor, por lo tanto, en el punto de mayor temperatura es donde se concentra la reducción del FeO a Fe (rec. 3). A medida que el gas asciende por el horno, pierde temperatura, pero encuentra partículas que son más fáciles de reducir: de magnetita a wüstite (rec. 2), luego de hematita a magnetita (rec. 1). Finalmente, la mezcla gaseosa de hidrógeno y agua, a una temperatura inferior a 400ºC, sale el del reactor por la parte superior, directamente, al condensador, donde se retira el vapor de agua, antes de poder recircular el hidrógeno no consumido.
En el siguiente gráfico se puede observar como el poder reductor del hidrógeno es superior al del monóxido de carbono a partir de 760ºC, dado que, para ambas reducciones (Fe3O4 —> FeO —> Fe) es necesario un menor porcentaje del gas reductor para obtener el Fe.

La mayor ventaja del cambio de reductor se observa cuanto mayor es la temperatura, ya que se favorece la difusividad al aumentar la energía cinética del gas. Análogamente, el poder reductor del hidrógeno es más evidente en la reducción del FeO que en la reducción de Fe3O4. Lo que favorece la termodinámica de la etapa limitante.
Como se observa en las reacciones de reducción 1/2/3 arriba descritas, la estequiometria entre el H2 y el H2O es 1:1. Por lo tanto, por cada 2 g de hidrógeno consumidos, se generan 18 g de agua, es decir, 9g H2O/g H2. En el gráfico de la imagen 7, podemos observar cómo los ratios ( tienen que ser superiores a 2:1 a favor del H2:H2O (equivalentes a 66,7% en el eje x).
Así pues, la retirada del agua del reactor donde se produce la reducción es esencial.
Por esa razón, como se puede observar en la imagen 8, el condensador que está acoplado a la corriente de salida del reactor donde se da el DRI es fundamental. Ya que será necesario reducir el contenido del agua de la mezcla de salida de hidrógeno y agua. Por lo tanto, la ruta completa de la producción de acero verde tendría la siguiente forma.

Ha quedado documentado que el aumento de la temperatura favorece la reducción de hierro, sin embargo, existe un límite. En este caso es la temperatura de fusión del hierro (1538 ºC). Como el proceso de DRI se lleva a cabo en estado sólido, no es recomendable operar a temperaturas superiores a 1200ºC. Ya que, sobrepasando ese umbral, las partículas individuales tienden a fusionarse en partículas más grandes, disminuyendo el área superficial y, por lo tanto, se reduce la reactividad del sustrato.








Muchas gracias Ager, gran resumen e ilustracion